QUÍMICA - PROFESSORA SHEILA
ENSINO MÉDIO - 1º ANO C/1º ANO D/1º ANO E/2º ANO A/2º ANO B/2º ANO C/2º ANO D
ATIVIDADES PARA: 1º ANO C / 1º ANO D/1º ANO E
Exercícios
1) Indique matéria, corpo e objeto na relação abaixo:
a) madeira b) copo c) cadeira d) vidro
e) panela f) alumínio g) tijolo h) pedra
i) areia j) água l) mesa m) plástico
n) argila o) telha p) cinzeiro q) caco de vidro
r) paralelepípedo s) granito t) pote u) ouro
(pedra)
2) Identifique matéria e energia na relação abaixo:
a) ar atmosférico b) madeira c) trovão d) luz
e) calor f) pólvora g) fumaça h) vidro
i) eletrecidade j) raio l) plástico m) petróleo
3) Dê os símbolos dos seguintes elementos:
a) Hidrogênio e) sódio
b) oxigênio f) ferro
c) carbono
d) magnésio
4) Dê os símbolos dos seguintes elementos:
a) sódio e) chumbo
b) potássio f) fósforo
c) cobre g) ouro
d) mercúrio h) prata
5) Desenhe o modelo atômico atual. Indique: núcleo, eletrosfera, prótons, nêutrons e elétrons.
Exercícios complementares de Química
14. Assinale o número de moléculas:
ENSINO MÉDIO - 2º ANO A/2º ANO B/2º ANO C/2º ANO D
Soluções
ATIVIDADES PARA: 1º ANO C / 1º ANO D/1º ANO E
COMPETÊNCIA ESPECÍFICA: Analisar fenômenos naturais e processos tecnológicos, com base nas relações entre matéria e energia, para propor ações individuais e coletivas que aperfeiçoem processos produtivos, minimizem impactos socioambientais e melhorem as condições de vida em âmbito local, regional e/ou global.
Exercícios
1) Indique matéria, corpo e objeto na relação abaixo:
a) madeira b) copo c) cadeira d) vidro
e) panela f) alumínio g) tijolo h) pedra
i) areia j) água l) mesa m) plástico
n) argila o) telha p) cinzeiro q) caco de vidro
r) paralelepípedo s) granito t) pote u) ouro
(pedra)
2) Identifique matéria e energia na relação abaixo:
a) ar atmosférico b) madeira c) trovão d) luz
e) calor f) pólvora g) fumaça h) vidro
i) eletrecidade j) raio l) plástico m) petróleo
3) Dê os símbolos dos seguintes elementos:
a) Hidrogênio e) sódio
b) oxigênio f) ferro
c) carbono
d) magnésio
4) Dê os símbolos dos seguintes elementos:
a) sódio e) chumbo
b) potássio f) fósforo
c) cobre g) ouro
d) mercúrio h) prata
5) Desenhe o modelo atômico atual. Indique: núcleo, eletrosfera, prótons, nêutrons e elétrons.
Exercícios complementares de Química
1. Qual das
alternativas a seguir contém apenas substâncias compostas?
a) N2, P4, S8
b) CO, He, NH3
c) CO2, H2O, C6H12O6
d) N2,
O2, H2O
e) H2O, I2, Cl2
2. (Mack-SP)
Qual o número de substâncias simples com atomicidade par entre as substâncias
de fórmula O3, H2O2, P4, I2,
C2H4, CO2 e He?
a) 0
b) 1
c) 2
d) 3
e) 4
3. (Cesgranrio-RJ)
Identifique a alternativa que apresenta, na seqüência, os termos corretos que
preenchem as lacunas da seguinte alternativa: “Uma substância ............... é
formada por ..............., contendo apenas ............... de um mesmo
............... .”
a) composta; moléculas; elementos; átomo
b) composta; moléculas; átomos; elemento
c) química; elementos; moléculas; átomo
d) simples; átomos; moléculas; elemento
e) simples; moléculas; átomos; elemento
4. Considerando-se
a reação: C + H2O CO + H2. Qual o número de
substâncias simples e compostas, respectivamente, existentes nessa
reação?
a) 0 e 4
b) 1 e 3
c) 2 e 2
d) 3 e 1
e) 4 e 0
5. (F.São Marcos-SP)
Dentre as substâncias abaixo, é uma substância simples o:
a) HCl
b) NH3
c) Br2
d) H2O
e) CaO
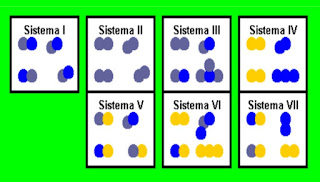
Sobre esses sistemas, a
afirmação incorreta é:
a) II contém uma substância pura;
b) III contém uma mistura;
c) I contém duas substâncias simples;
d) II contém uma mistura;
e) I contém uma mistura;
No esquema a seguir estão
representados sete sistemas (I a VII), formados por moléculas constituídas por
três tipos de átomos. Responda os testes seguintes relativos à classificação
desses sistemas:
7. Quais são substâncias
puras?
a) I, IV e V
b) II, V e VI
c) somente II
d) V, VI e VII
e) I e II
8. Qual o número de
elementos participantes de todos os sistemas?
a) 1
b) 2
c) 3
d) 4
e) 5
9. Quantas substâncias
simples diferentes existem no total?
a) 2
b) 3
c) 4
d) 5
e) 6
10.Quantas substâncias
compostas diferentes existem no total?
a) 2
b) 3
c) 4
d) 5
e) 6
11. Qual o número de átomos
presentes?
a) 4
b) 5
c) 7
d) 8
e) 9
12. Qual o
número de elementos?
a) 1
b) 2
c) 3
d) 4
e) 5
13. Assinale o
número de substâncias simples:
a) 0
b) 1
c) 2
d) 3
e) 4
14. Assinale o número de moléculas:
a) 1
b) 2
c) 3
d) 4
e) 5
15. Qual o número de
substâncias compostas?
a) 0
b) 1
c) 2
d) 3
e) 4
16. (UNISA-SP) Em qual
das seqüências a seguir, estão representados um elemento, uma substância
simples e uma substância composta, respectivamente?
a) H2 , Cl2 , O2
b) H2 , Ne , H2O
c) N , HI , He
d) H2O , O2 , H2
e) Cl , N2 , HI
17. (UNESP-SP) Os
nomes latinos dos elementos chumbo, prata e antimônio dão origem aos símbolos
químicos desses elementos. Esses símbolos são respectivamente:
a) P, Ar, Sr
b) Pm, At, Sn
c) Pb, Ag, Sb
d) Pu, Hg, Si
e) Po, S, Bi
18. Considerando as
fórmulas moleculares da água (H2O), gás clorídrico (HCl), gás
carbônico (CO2), gás oxigênio (O2), gás hidrogênio (H2),
gás cloro (Cl2), gás ozônio (O3), assinale a alternativa
que apresenta apenas substâncias simples:
a) água, gás clorídrico, gás carbônico, gás oxigênio
b) gás carbônico, gás oxigênio, gás hidrogênio, gás
cloro
c) gás hidrogênio, gás oxigênio, gás cloro, gás ozônio
d) água, gás cloro, gás carbônico, gás oxigênio
e) gás hidrogênio, gás carbônico, gás oxigênio, gás
clorídrico
19. (UFSC adaptado) As
substâncias químicas podem ser classificadas em simples ou compostas.
Selecione, abaixo, a opção que apresenta uma substância simples:
a) H2O, Hg, HI, Fe
b) CO2, HCl, H2S, SO2
c) CO, NaCl, CH4, CO2
d) H2SO4, SiO2, O2, H3PO4,
e) Au, Ag, H2, N2
20. Observe as
fórmulas:CO, Co, N2, NO2, CO2, C, C3H6O,
H2O, H2O2, H2, O2, Fe
e Pb. e assinale o número de substâncias compostas?
a) 3
b) 4
c) 5
d) 6
e) 8
21. A figura
representa recipientes contendo algumas moléculas de gás oxigênio e
gás ozônio. O gás oxigênio tem fórmula O2 e sabemos que é
fundamental para a grande maioria dos seres vivos. Por outro lado, o gás ozônio
(O3) é tóxico ao nível do solo, porém, constitui uma camada
protetora contra a radiação ultravioleta dos raios solares. A respeito dos
recipientes, um aluno comentou:
-Cada recipiente possui
doze átomos do elemento químico oxigênio;
-Em ambos os recipientes há
o mesmo número de moléculas;
-Cada recipiente representa
uma substância pura composta;
Qual o número de comentários corretos?
a) nenhum
b) um
c) dois
d) três
e) quatro
22. O ácido fosfórico,
encontrado em muitos refrigerantes, possui H3PO4. Pode-se
afirmar que:
a) A molécula de ácido fosfórico apresenta sete átomos;
b) O índice 4 indica que o elemento fósforo comparece com
quatro átomos;
c) A molécula contém três átomos de hidrogênio;
d) A molécula é formada por quatro elementos químicos;
e) O hidrogênio apresenta o maior número de átomos.
23. Com quem a Química
tornou-se uma ciência?
a) Demócrito
b) Rutherford
c) Lavoisier
d) Dalton
e) Thomson
24. Analise as
afirmativas:
I-Substâncias puras simples
são formadas por átomos de apenas um elemento químico;
II-Substâncias puras
compostas são formadas por átomos de apenas dois elementos químicos;
III-As substâncias puras
são representadas por fórmulas químicas;
IV-As misturas são
representadas por fórmulas químicas.
Estão corretas:
a) somente I e IV
b) somente II e III
c) somente I e II
d) somente III e IV
e) somente I e III
25. (FAEE-GO) A
seqüência na qual todas as substâncias simples apresentam atomicidades
diferentes entre si é:
a) H2 , H2O , H2O2 e
O2
b) S8 , Fe , O2 e P4
c) F2 , Al , N2 e O3
d) CH4 , CCl4 , H2SO4 ,
HClO4
e) Na2O , NaCl , HCl , H2O
26. (UnB-DF adaptado)
Julgue os itens:
I-As substâncias são
representadas por fórmulas;
II-As moléculas são
constituídas por átomos;
III-Os átomos são
constituídos por elementos;
IV-A água, de fórmula H2O,
possui apenas dois átomos;
V-O álcool etílico (C2H5OH)
é uma substância composta.
São verdadeiras:
a) somente III e IV
b) somente I
c) somente V
d) somente I, II e V
e) somente II e III
Observe o desenho e
responda os testes finais:
27. Assinale o número
de moléculas:
a) 9
b) 8
c) 7
d) 4
e) 3
28. Quantas substâncias
compostas?
a) 1
b) 2
c) 3
d) 4
e) 5
29. Qual o número de
componentes da mistura?
a) 1
b) 2
c) 3
d) 4
e) 5
30. Assinale o número de
substâncias simples:
a) 5
b) 4
c) 3
d) 2
e) 1
Enviar as atividades para o e-mail: scsquim@gmail.com
ENSINO MÉDIO - 2º ANO A/2º ANO B/2º ANO C/2º ANO D
COMPETÊNCIA ESPECÍFICA : Construir e utilizar
interpretações sobre a dinâmica da Vida, da Terra e do Cosmos para elaborar
argumentos, realizar previsões sobre o funcionamento e a evolução dos seres
vivos e do Universo, e fundamentar decisões éticas e responsáveis.
A água pura (apostila do aluno 2ano – vol 1)
A vida, como a conhecemos, depende da água, a
substância mais abundante nos tecidos animais e vegetais, bem como na maior
parte do mundo que nos cerca. Três quartos da superfície terrestre são cobertos
de água: 97,2% formam os oceanos e mares; 2,11%, as geleiras e calotas polares;
e 0,6%, os lagos, os rios e as águas subterrâneas. Esta última é a fração de
água aproveitável pelo homem, que pode utilizá-la para abastecimento doméstico,
indústria, agricultura, pecuária, recreação e lazer, transporte, geração de
energia e outros ande São Paulo são produzidos 5,8 bilhões de litros de água
tratada por dia. Essa água provém dos Sistemas Cantareira, Alto do Tietê e Rio
Grande. Embora a ONU recomende o consumo per capita de 110 litros de água, a
média da capital tem sido de 221 litros por dia por habitante (dados de 2008).
Levando-se em conta não só o consumo, mas também a perda de água por
vazamentos, desperdício e outros, o Instituto Socioambiental (ISA) está
promovendo uma campanha para combater o desperdício de água. Tanto as águas
“doces” como as “salgadas” são imensas soluções aquosas, que contêm muitos
materiais dissolvidos. Assim, a água na
natureza não se encontra quimicamente pura. Mesmo as águas da chuva e a
destilada nos laboratórios apresentam gases dissolvidos, como o CO2,
o O2 e o N2, provenientes de sua interação com a
atmosfera. É a presença desses gases e também de sais e outros compostos que
torna a água capaz de sustentar a
vida aquática – os peixes e outros seres não
poderiam viver em água pura: eles necessitam do oxigênio dissolvido na água
para sua respiração. Uma substância apresenta um conjunto de propriedades
específicas que podem ser usadas
para a sua identificação.
Elaborado por Maria Eunice Ribeiro Marcondes e Yvone Mussa Esperidião especialmente para
o São Paulo faz escola.
A água
potável
A palavra potável vem do latim potábilis, que significa “própria para
beber”. Para ser ingerida, é essencial que a água não contenha elementos
nocivos à saúde. Muitas vezes, as águas superficiais provenientes de rios,
lagos ou de afloramentos naturais, destinadas ao consumo humano ou a outros
fins, não apresentam a qualidade sanitária exigida. Por essa razão, a água para
consumo humano deve passar por tratamento a fim de torná-la potável, isto é,
atender a certos requisitos estéticos, tais como ser isenta de cor, sabor, odor
ou aparência desagradável, ou seja, ser própria para beber. Também pode ser
utilizada no preparo de alimentos ou para lavar louças e roupas. Deve ser também
isenta de substâncias minerais ou orgânicas ou organismos patogênicos que
possam produzir agravos à saúde. Assim, o critério de potabilidade é diferente
do critério de pureza. A potabilidade tem como fim o auxílio da manutenção dos
seres vivos, inclusive o ser humano. A pureza indica que a única espécie
química existente é H2O, que tem propriedades específicas que a
caracterizam.
Elaborado por Maria Eunice Ribeiro Marcondes e Yvone Mussa Esperidião
especialmente para o São Paulo faz
escola.
Questões para análise do texto
1.
Por que
se afirma que a vida depende da água? Onde a utilizamos? Qual é sua importância
para o ser humano?
2. Compare, em termos de ordem de grandeza, a
fração de água aproveitável pelo ser humano com as frações dos demais corpos de
água do planeta.
Soluções
São
misturas homogêneas (aspecto uniforme) que apresenta dois componentes
principais, chamado de soluto e solvente.
Podemos
ter vários tipos de soluções. Observe:
·
Solução
sólida: ligas metálicas, tais
como bronze (Cu+Sn) e latão (Cu+Zn);
·
Solução
gasosa: ar atmosférico;
·
Solução
liquida: Podemos ter um sólido
dissolvido em um líquido, ou então, dois líquidos dissolvidos entre si. São
formados por uma ou mais substâncias dissolvidas (soluto) num líquido
(solvente). Seus componentes não podem ser separados por filtração. Sua
separação pode ocorrer usando outros processos físicos, tais como a destilação.
O
soluto sempre irá representar o componente que se encontra dissolvido em uma
outra substância que, no caso, será o solvente. Ainda com base na definição, é
possível dizer que o soluto sempre será a espécie que se encontra em menor
quantidade.
Coeficiente de
solubilidade: é a quantidade
de soluto que se encontra dissolvido em uma quantidade padrão (mínima) de
solvente a uma determinada temperatura. Normalmente a quantidade de solvente
mais usada é de 100g.
q Solução
saturada: é toda solução em que o soluto atinge o seu coeficiente de
solubilidade na temperatura fornecida;
q Solução
saturada com corpo de fundo: é toda solução em que a quantidade de soluto
dissolvida ultrapassa o coeficiente de solubilidade (ponto de saturação);
q Solução
supersaturada: é quando excede a quantidade máxima de soluto a ser
dissolvida de acordo com o coeficiente de solubilidade, sendo que o excesso de
soluto é dissolvido por variação de temperatura.
v Concentração
comum (C): Determina a quantidade de massa de soluto (m1)
em gramas por unidade de volume (V) de solução (L).
1. Qual
a concentração de uma solução contendo 40g de cloreto de sódio dissolvidos em
250 mL de solução?
2. Uma
solução foi preparada adicionando-se 40g de hidróxido de sódio em água
suficiente para produzir 200 mL de solução. Calcule a concentração comum dessa
solução. R:200
3. Calcule a concentração
comum de uma solução de nitrato de prata, sabendo que ela encerra 120g do sal
em 600 cm3 de solução.
4. Determine a massa de
ácido nítrico, em gramas, necessária para a preparação de 150 mL de
uma solução de concentração 50g/L.
5. (Faap-SP) Calcule a
concentração, em g/L, de uma solução aquosa de nitrato de sódio que contêm 30g
de sal em 400 mL de solução.
6. (Mack-SP) Qual a
concentração, em g/L, da solução obtida ao se dissolverem 4g de cloreto de
sódio em 50 cm3 de solução?
7. São
dissolvidos 24g de sacarose em água suficiente para 500mL de solução. Qual é a
concentração comum dessa solução?
8. Calcule
a concentração comum de uma solução que apresenta volume de 800mL e contém 80g
de soluto.
9. (PUCCamp-SP)
Evapora-se totalmente o solvente de 250 mL de uma solução aquosa de cloreto de
magnésio de concentração 8,0g/L. Quantos gramas de soluto são obtidos?
10. São
dissolvidos 200g de cloreto de sódio em água suficiente para 2 litros de
solução. qual é a concentração comum dessa solução?
1. Se um
corpo tem a massa de 20 g em um volume de 5 cm3 , qual é a sua
densidade ?
2. Determine
a massa de um corpo cuja densidade é de 5 g/cm3 em um volume de
3 cm3.
3. Uma
pedra tem 52 g e volume igual a 20 cm3.
Determine a densidade em kg/m3.
4. Bromo é
um líquido vermelho acastanhado com densidade de 3,10 g/mL. Que volume ocupa
uma amostra de 88,5 g de bromo?
5. A
densidade do selênio é 4,79 g/cm3. Qual a massa, em kg, de 6,5
cm3 de selênio?
6. O
etanol tem a densidade de 0,789 g/cm3. Que volume deve ser medido
numa proveta graduada para se ter 19,8 g de etanol?
7. A
densidade do diamante é 3,5 g/cm3. A unidade prática internacional
para a pesagem de diamantes é o quilate, que corresponde a 200 mg. Qual o
volume de um diamante de 1,5 quilate?
8. Quando
se deixa cair uma peça de metal com massa 112,32 g em um cilindro graduado que
contém 23,45 mL de água, o nível de água sobe para 29,27 mL. Qual a densidade
do metal em g/cm3?
9. Qual o
volume, em litros, ocupado por 5 g de prata sólida cuja densidade é 10,5 g/cm3?
10. Um líquido, com volume de 10,7 mL,
tem a massa de 9,42 g. O líquido pode ser octano, etanol ou benzeno, cujas
densidades são, respectivamente (em g/cm3), 0,702, 0,789 e
0,879. Qual é o líquido? Justifique a resposta
Enviar as atividades para o e-mail: scsquim@gmail.com









E de todos os primeiros?
ResponderExcluirNão, só do que tem aula de Química com a professora Sheila.
Excluiré para mandar por email,e fazer no caderno também?
ResponderExcluirSim, leia a postagem Entrega de atividades e prazos
ExcluirMinha sala não tem física com a professora Sheila é pra fazer mesmo assim, sou do 2º ano
ResponderExcluirEntão espera a postagem da sua sala.
ExcluirÉ pro segundo b?
ResponderExcluirSim, todos. Leiam.
ExcluirA minha sala também não tem aula com a prof sheila (1°)
ResponderExcluirEntão espera a postagem da sua sala.
ExcluirQual o prazo de entrega?
ResponderExcluirLeia a postagem Entrega de atividades e prazos.
ExcluirsertheiXhyp_ke Travis Shepard https://marketplace.visualstudio.com/items?itemName=1pusresva-re.Dream-Alone-gratuita
ResponderExcluirbricasimar
suriocompge Mike Abeita https://www.the11thhourblog.com/profile/Cloud-Computing-Design-Patterns-Thomas-Erl-Pdf-13-NEW/profile
ResponderExcluirspicasalbut
cobiZmate-1988 Cedric Quinn download
ResponderExcluirlink
https://colab.research.google.com/drive/1MPYrHeFA6Vt7lCWBlEmNnVzaEN5-7FYi
link
foundcalquitab